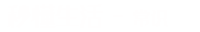NaHCO3+NaOH =Na2CO3+H2O
HCO3- +OH-= H2O+CO32-
与H2O和CO2
Na2CO3+CO2+H2O =2NaHCO3
CO32-+H2O+CO2 =H CO3-
不反应
1.在碳酸钠溶液中滴加稀盐酸:Na2CO3+ HCl = NaCl+NaHCO3 NaHCO3+ HCl = NaCl+H2O+CO2↑(过一会有气泡)
在碳酸氢钠中加入稀盐酸:NaHCO3+ HCl = NaCl+H2O+CO2↑(迅速产生大量气体)
在盐酸中加入碳酸钠溶液:Na2CO3+ 2HCl = 2NaCl+H2O+CO2↑(产生大量气体 较慢)
2.在碳酸钠溶液中通入二氧化碳:Na2CO3+CO2+H2O=2NaHCO3
3.碳酸氢钠受热分解:2NaHCO3△(=====)Na2CO3+H2O+CO2↑
4.氢氧化钠与碳酸氢钠反应:NaOH+NaHCO3=Na2CO3+H2O
鉴别碳酸钠与碳酸氢钠的物质可以是酸、盐,不能为碱
二、 氯及其化合物的性质
1、液氯、新制的氯水和久置的氯水比较
2、Cl2的用途:①自来水杀菌消毒Cl2+H2O == HCl+HClO 2HClO ===(光照) 2HCl+O2 ↑ 其中次氯酸HClO有强氧化性和漂泊性,起消毒漂白作用 。次氯酸有弱酸性,不稳定,光照或加热分解,因此久置氯水会失效 。
②制漂白液、漂白粉和漂粉精
制漂白液: Cl2+2NaOH=NaCl+NaClO+H2O ,其有效成分NaClO比HClO稳定多,可长期存放
制漂白粉(有效氯35%)和漂粉精(充分反应有效氯70%) : 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
3、氯气的性质
2Na+Cl2点燃(=====)2NaCl( 白烟)H2+Cl2点燃(=====)2HCl (白雾)磷在氯气中燃烧(白色烟雾)
4.氯气与氢氧化钠的反应Cl2+2NaOH=NaCl+NaClO+H2O(氯气的尾气处理)
5.制取漂白粉(氯气能通入石灰浆)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O CaCl2和Ca(ClO)2叫漂白粉
漂白粉在空气中变质:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
三、 以物质的量为中心的物理量关系
1.物理量-物质的量 单位-摩尔(mol)
①n= N/NA N代表微粒个数 NA阿伏加德罗常数 NA≈6.02×1023 mol-1
2.物质的摩尔质量M
②n= m/M
M代表物质质量 M为摩尔质量,数值上等于该物质的相对原子质量或相对分子质量,单位g?mol-1
3.气体的摩尔体积Vm
③n=V/Vm V为气体体积,单位是升(L) Vm是气体摩尔体积,标准状况下,1 mol气体为22.4 L
Vm温度、压强一定时为定值,Vm单位为L ?mol -1
阿伏伽德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子 。所以又叫四同定律,也叫五同定律(五同指同温、同压、同体积、同分子个数、同物质的量)
推论:定律
(1)同温同压下,V1/V2=n1/n2
(2)同温同体积时,p1/p2=n1/n2=N1/N2
(3)同温同压等质量时,V1/V2=M2/M1
4.溶液中溶质的物质的量浓度c
④n=cV C为溶液中溶质的物质的量浓度,单位为mol? L -1 V为溶液体积,单位是升(L)
5.一定物质的量浓度溶液的配制及误差分析
(1)容量瓶是配制一定物质的量浓度溶液的仪器,其常用规格有50 mL、100 mL、250 mL、500 mL、1000 mL等,使用时一定要注意其规格,如500 mL容量瓶 。并且使用前一定要检查其是否漏水 。
(2)配制步骤,所用仪器及注意事项
配制步骤
使用仪器
注意事项
计算
——
固体求溶质质量,液体求其体积 。
称量
托盘天平或量筒
天平的精确度为0.1 g,量筒的精确度为0.1 mL,量筒量取液体后不需要洗涤 。
溶解/稀释
烧杯、玻璃棒
溶解要在小烧杯中,切不可在容量瓶中直接溶解 。
冷却
——
将液体恢复到室温(20℃)
转移
Xml容量瓶
转移时要用玻璃棒引流,以防液体溅失
洗涤
——
洗烧杯和玻璃棒2—3次,并将洗涤液转入容量瓶
振荡
——
使溶液充分混合
定容
胶头滴管
加水至刻度线1—2 cm时,用胶头滴管滴加,并使视线、刻度线、凹液面相切 。
摇匀
——
两手握住容量瓶,上下颠倒摇匀 。
装瓶贴签
试剂瓶
容量瓶不能用于长期贮存溶液 。
(3)误差分析
由公式知,凡是溶质的物质的量减少或使溶液体积增大的操作,都会使c偏低,反之偏高 。
四、物质的分类
2、氧化物的分类
秒懂生活扩展阅读
- 如何判断化学反应是否定量进行
- 氧化碳的化学式是
- 高中化学二氧化硅和硅的用途
- 2205双相不锈钢的化学成分
- 高中选课对大学选专业有影响吗
- 化学中的熟化和陈化有什么区别
- 刘耀文现身重点高中被举报! 刘耀文个人资料
- 红宣纸掉色么
- 元素周期表顺口溜完整版 化学元素周期表口诀歌
- 水的化学分子式是多少 水的化学式