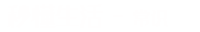CH?Cl+Cl?=光照=CH?Cl?+HCl
CH?Cl?+Cl?=光照=CHCl?+HCl
CHCl?+Cl?=光照=CCl?+HCl
加成反应:
CH?=CH?+Cl?=催化剂=CH?ClCH?Cl(1,2-二氯乙烷)
和二硫化碳反应:
氯气有哪些性质?氯单质由两个氯原子构成,化学式为Cl2 。气态氯单质俗称氯气,液态氯单质俗称液氯 。
在常温下,氯气是一种黄绿色、刺激性气味、有毒的气体 。压强为1.01×105Pa时,氯单质的沸点为?34.4℃,熔点为?101.5℃ 。氯气可溶于水和碱性溶液,易溶于二硫化碳和四氯化碳等有机溶剂,饱和时1体积水溶解2体积氯气 。
氯气具有强烈的刺激性、窒息气味,可以刺激人体呼吸道黏膜,轻则引起胸部灼热、疼痛和咳嗽,严重者可导致死亡 。
[编辑]
化学性质
氯气的化学性质很活泼,它是一种活泼的非金属单质 。
氯原子的最外电子层有7个电子,在化学反应中容易结合一个电子,使最外电子层达到8个电子的稳定状态,因此氯气具有强氧化性 。
物理属性
熔点
171.6
K(?101.5
°C)
沸点
239.11
K(?34.04
°C)
摩尔体积
17.39
×
10?6
m3/mol
汽化热
10.2
kJ/mol
熔化热
3.203
kJ/mol
蒸气压
1300
帕
声速
无数据
其他性质
电负性
3.16
(鲍林标度)
比热
480
J/(kg·K)
电导率
无数据
热导率
0.0089
W/(m·K)
第一电离能
1251.2
kJ/mol
第二电离能
2298
kJ/mol
第三电离能
3822
kJ/mol
第四电离能
5158.6
kJ/mol
第五电离能
6542
kJ/mol
第六电离能
9362
kJ/mol
第七电离能
11018
kJ/mol
第八电离能
33604
kJ/mol
第九电离能
38600
kJ/mol
第十电离能
43961
kJ/mol
氯气的性质是什么?氯气的性质是:助燃性 。
有助燃性,氯气支持燃烧,许多物质都可在氯气中燃烧(除少数物质如碳单质等) 。
氧化性:氯气具有强氧化性,加热下可以与所有金属反应 。
(1)与钠的反应:2Na+Cl2=2NaCl
现象:钠在氯气里剧烈燃烧,产生大量的白烟,放热 。
(2)与铜的反应:Cu+Cl2=CuCl2
现象:红热的铜丝在氯气里剧烈燃烧,瓶里充满棕黄色的烟,加少量水后,溶液呈蓝绿色(绿色较明显),加足量水后,溶液完全显蓝色 。
氯气的特性:
氯气中混和体积分数为5%以上的氢气时遇强光可能会有爆炸的危险 。氯气具有毒性,主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,会对上呼吸道黏膜造成损害 。
氯气能与有机物和无机物进行取代反应和加成反应生成多种氯化物 。主要用于生产塑料(如PVP)、合成纤维、染料、农药、消毒剂、漂白剂溶剂以及各种氯化物 。
以上资料参考 百度百科—氯气
氯气的物理和化学性质氯气,化学式为Cl 。常温常压下为黄绿色有毒气体,易压缩可液化为金黄色液态氯,是氯碱工业的主要产品之一,可用作为强氧化剂 。氯气中混合体积分数为5%以上的氢气时遇强光可能会有爆炸的危险 。氯气能与有机物和无机物进行取代反应和加成反应生成多种氯化物 。氯气在早期作为造纸、纺织工业的漂白剂 。
物理性质
通常情况下为有强烈刺激性气味的黄绿色的有毒气体 。可溶于水,且易溶于有机溶剂(例如:四氯化碳),难溶于饱和食盐水 。1体积水在常温下可溶解2体积氯气,形成黄绿色氯水,密度为3.170g/L,比空气密度大 。
秒懂生活扩展阅读
- 泛性恋的简单介绍
- mybatis分页 mybatis
- 请问南通市初中学校的质量排名
- 香雪兰球根保存的方法
- 融入团队的益处是什么
- 寻声暗问弹者谁的暗是什么意思
- 如何驯服仓鼠
- 泉州|适合穷游的城市:景点基本全免费,街上茶水随意喝
- 迪迦的爸爸是谁
- 怎么更换电影的字幕